研究内容
ウイルスの増殖機構を探り、制御する!
私たちはインフルエンザウイルス、エボラウイルス、ラッサウイルスなどヒト病原性ウイルスに焦点を当て、細胞内増殖機構や病態発現機構の解明を目指しています。また、これら基礎研究を通じて得られた科学的根拠をベースに新規治療法の開発を目指しています。 本研究室は、クライオ電子顕微鏡など多様な電子顕微鏡法を駆使した視覚的な解析を得意としており、ウイルス粒子や感染細胞の詳細な構造をさまざまな分解能で解明することができる日本で唯一の研究室です。また、ヒト呼吸器オルガノイドを用いた新規ウイルス感染モデルの確立を通じて、株化培養細胞を用いた解析では得られない、ヒト体内におけるウイルス増殖機構や感染応答の真の理解を目指しています。従来からの研究手法のみにとらわれることなく、構造生物学や発生学など異分野の手法や知見を取り入れた革新的な研究を進め、ウイルス学に新たな道を切り開くことを目指しています。
インフルエンザウイルスの遺伝機構
インフルエンザウイルスのゲノムRNAは8本に分節化しています。しかし、8本に分かれたゲノム分節が子孫ウイルス粒子にどのように取り込まれるのか、長年の謎でした。私たちはインフルエンザウイルスを人工合成するリバースジェネティクス法や様々な電子顕微鏡法を組み合わせ、8種類8本のゲノム分節が規則的な配置をとって子孫ウイルス粒子に選択的に取り込まれることを解明しました。現在はその分子機構の解明を目指しています。(図)電子線トモグラフィー法により3次元再構築したインフルエンザウイルス粒子。
[参考文献:Noda et al. Nature 2006; Muramoto et al. J Virol 2006; Noda et al. Nat Commun 2012; Sugita et al. J Virol 2013; Noda et al. Nat Commun 2018; Miyamoto et al. J Virol 2022]
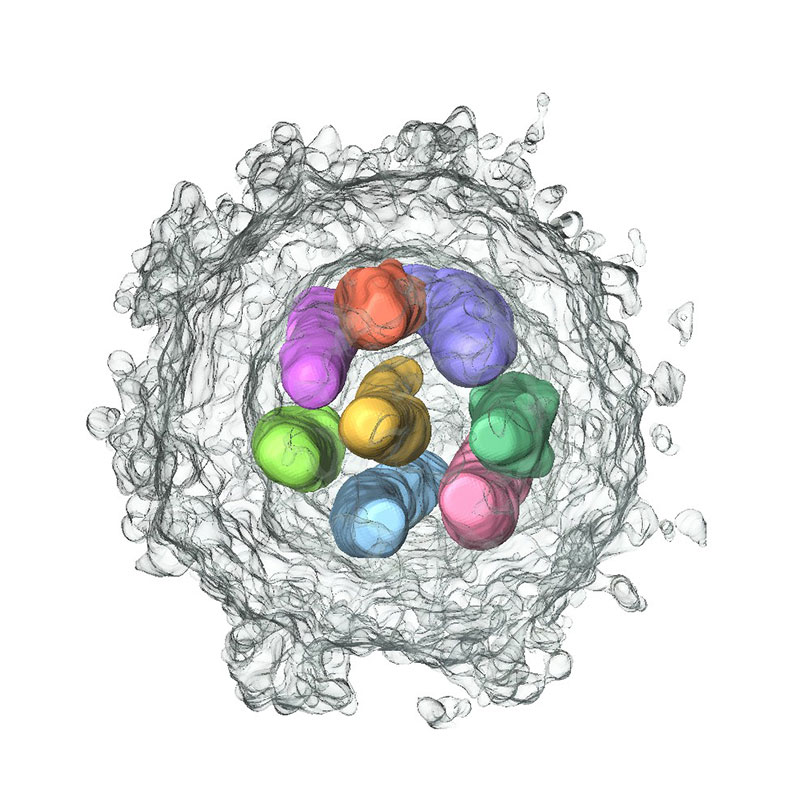
エボラウイルスのヌクレオカプシド形成機構とその機能発現制御機構
エボラウイルスのヌクレオカプシドはゲノムRNAとNP、VP24、VP35、VP30、Lから構成された螺旋状の巨大な複合体であり、ゲノムRNAの転写・複製および子孫ウイルス粒子への輸送などさまざまな機能を発揮します。しかしその詳細な構造は未決定のままです。私たちはクライオ電子顕微鏡法により、ヌクレオカプシドのコア構造となる螺旋状NP-RNA複合体の構造を高分解能で決定しました。さらにVP24分子が結合したNP-RNA複合体の高分解能構造も決定し、VP24分子によるヌクレオカプシドの転写複製制御機構を解明しました。(図)クライオ電子顕微鏡法により決定したマールブルクウイルス(エボラウイルスと近縁のウイルス)のNP-RNA複合体の構造。
[参考文献:Noda et al. PLoS pathog 2006; Noda et al. J Gen Virol 2010; Sugita et al. Nature 2018; Fujita-Fujiharu et al. Nat Commun 2022; Hu et al. PNAS Nexus 2023]

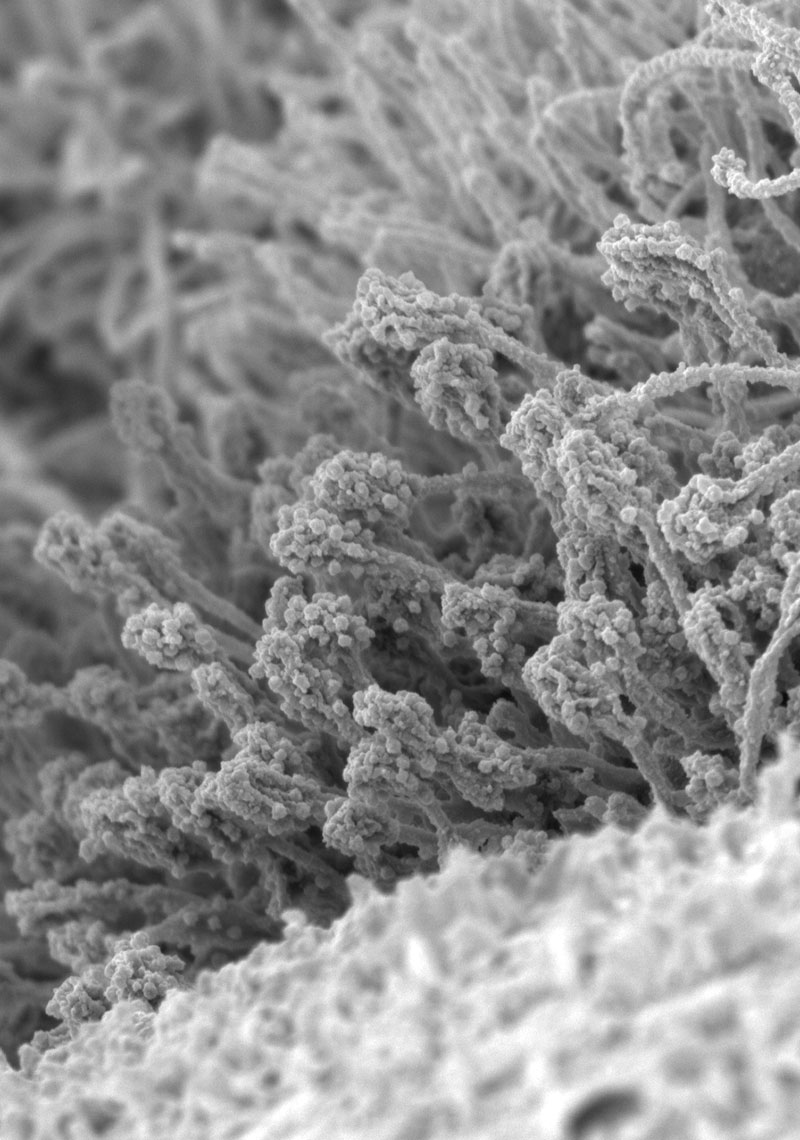
ヒト呼吸器オルガノイドの開発と新規ウイルス感染系の確立
従来のウイルス学研究では、本来の感染宿主とは異なる動物種(イヌやサルなど)や標的臓器(腎臓細胞など)の株化培養細胞を用いることが多く、ヒト呼吸器における感染増殖機構や感染応答を正確に反映した解析系とは言えませんでした。そこで私たちはES細胞やiPS細胞からヒトの呼吸器上皮を作製し、ヒト体内における感染増殖機構や宿主の感染応答の解析を進めています。また、本オルガノイドを応用して動物ウイルスがヒトに伝播する可能性を評価する実験系の確立を目指しています。(図)ヒトES細胞から作製した鼻腔上皮オルガノイドの走査電子顕微鏡像。
[参考文献:Muramoto et al. Lancet Microbe 2023]