研究分野
ナノスケールの力学を利導したバイオテクノロジーの創出
2023年4月に設立された当分野は、細胞集団が如何にして複雑な生命現象を創発するか?という根源的な問いに対して、1細胞から個体に渡るスケール横断的な理解を目指した研究をおこなっています。そのためのツールとして、マイクロ・ナノ流体力学や界面動電学を活用した新規オミクス計測手法を開発しています。当研究室では、基礎生物学、がん生物学、生物物理学、機械工学など、さまざまな分野の専門家が連携することで、学際的な研究を進めています。最近の成果としては、細胞表面張力と遺伝子発現を1細胞解像度で大規模同時計測できるELASTomics (electroporation-based lipid-bilayer assay for cell surface tension and transcriptomics) を開発しました。また、蛍光色コードとDNAバーコードの組み合わせから1細胞の顕微鏡画像と遺伝子発現を統合するopto-combinatorial indexing法を開発しました。私たちは、学際的な交流が活発である医生物学研究所の環境を最大限に活用し、共に知識の限界を広げ、医生物学や工学におけるブレークスルーを目指しています。
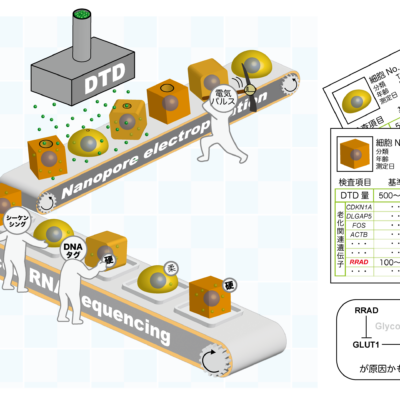
細胞表面張力と遺伝子発現の1細胞大規模同時計測法(ELASTomics)
細胞の力学的性質は、老化や細胞分化、がん細胞の浸潤といったさまざまな生命現象・疾患に関与しています。細胞の力学的性質をつかさどる遺伝子制御メカニズムを理解するために、ナノエレクトロポレーションによる細胞内への物質輸送技術と1細胞RNAシーケンシングを組み合わせることにより、1細胞の力学特性と遺伝子発現を同時かつ大規模に測定するELASTomics法を開発しました(Shiomi et al., Nat Commun., 2024)

1細胞の顕微鏡画像と遺伝子発現を統合するopto-combinatorial indexing法
同一の遺伝子型をもつ細胞であっても、薬剤に対して多様な応答を示すことがあり、究極的にはがん細胞の薬剤耐性の獲得のように異なる細胞運命が生じます。このような不均一な薬剤応答を引き起こす分子カスケードを理解するために、顕微鏡観察により取得した細胞画像と次世代シーケンシング解析により取得した1細胞遺伝子発現データを統合するopto-combinatorial indexing法を開発しました (Tsuchida et al., LabChip, 2024)。