| 2018年5月9日 内在性レトロウイルスを抑え込む普遍的な仕組み -抑制性ヒストン修飾の体細胞での機能を解明- |
加藤 雅紀1†、 竹本 経緯子2†、 眞貝 洋一1
(1理化学研究所眞貝細胞記憶研究室、 2京都大学ウイルス・再生医科学研究所)
(†These authors contributed equally)
“A somatic role for the histone methyltransferase Setdb1 in endogenous retrovirus silencing”
Nature Communications 1683 (2018), DOI: 10.1038/s41467-018-04132-9
概要
哺乳動物のゲノムの約半分はトランスポゾン由来の繰り返し配列で占められており、なかでも内在性レトロウイルス(ERV)由来の配列は、ゲノムの約10%存在しています。ERVの異常発現はゲノムの安定的な機能を損なうため、DNAのメチル化やヒストン修飾といったエピジェネティック修飾によってその活性は抑制されています。胚の発生初期や始原生殖細胞の発生時期には、DNAのメチル化が大きく低下するため、DNAのメチル化に代わるバックアップ機構として、ヒストンH3の9番目のリジンのトリメチル化(H3K9me3)およびその修飾を行うヒストンメチル化酵素 Setdb1 が ERVの抑制に重要な役割を果たすことが報告されています。しかし、これまで体細胞の ERV領域における H3K9me3 修飾の役割については明らかになっていませんでした。
今回、Setdb1遺伝子をマウスES細胞およびさまざまな体細胞でノックアウトし(Setdb1 KO)、ERVが脱抑制するか、RNA-seq解析を行ったところ、ES細胞のみならず体細胞においてもそれぞれの細胞に特異的なERVの種類が脱抑制することが明らかになりました。また、網羅的なH3K9me3 ChIP-seq 解析から、Setdb1KOによって脱抑制するERVは、どの細胞種においても H3K9me3 修飾が保持されていることが分かりました。
マウス線維芽細胞で Setdb1 KO を行うと、ほぼ全てのERV領域で H3K9me3 の減少がみられますが、VL30ファミリーに属するERVのみが強く脱抑制します。VL30ファミリーは LTR の違いによって4クラスに分けられ、強く脱抑制するのはクラス1のみです。マウスゲノム中に存在するVL30クラス 1 は 71コピーあり、コピーごとに脱抑制度合いが異なります。脱抑制の弱いコピーの DNA配列に注目すると MAPK経路の下流に位置する転写因子の結合配列が破壊されていることが分かり、MAPK経路が VL30クラス 1 の発現に重要であり、Setdb1 KOによって転写因子が結合できるようになることが明らかになりました。
また、DNAのメチル化の影響を調べたところ、DNAメチル化酵素 Dnmt1 のノックダウンによって脱抑制するのは IAPファミリーに限られ、ほとんどのERVは脱抑制しないこと、一方 Setdb1 KO はDNAのメチル化の減少を引き起こしていませんでした。
これまで、DNAのメチル化が体細胞においては一般的にERVの発現抑制に重要であると考えられていましたが、本研究の結果から、ヒストン H3K9me3 修飾が ERV の抑制に普遍的な役割を持つ可能性が明らかとなりました。また、ERVの異常な発現は免疫応答反応を引き起こすことが示されており、ERVの抑制機構についての研究は、将来的には自己免疫疾患の発症メカニズムの解明につながると期待できます。
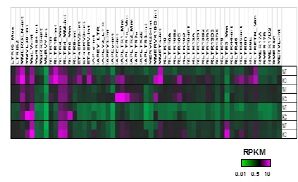
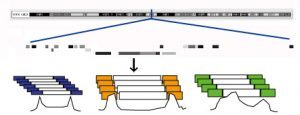
図1 様々なマウス細胞でSetdb1遺伝子をノックアウトしたRNA-Seq解析およびH3K9me3 Chip-Seq解析の模式図

図2 本研究で提唱したモデル
a) 野生型の細胞では、ヒストンメチル化酵素Setdb1がERV領域にヒストンH3K9me3修飾を入れることによってブレーキの役割を果たし、ERVの発現を抑制する。
b) Setdb1ノックアウト細胞では、H3K9me3修飾がなくなりブレーキが外れる。ただし、アクセルとなるものがない場合、ERVの発現は誘導されないままである。
c) Setdb1ノックアウト細胞で、それぞれのERVの発現に必要な転写因子がその細胞で発現もしくは活性化されているときのみ、ERVが脱抑制される。
詳しい研究成果はこちらをご覧ください。
