| 2025年5月15日 リポペプチド提示MHCクラス1分子はペプチド輸送体TAPを必要としない新しいキラーT細胞応答を誘導する |
鈴木拓1,2、国松友香1,2、吉岡佑弥1,2、麻実乃莉3、山崎晶3、杉田昌彦1、森田大輔1
(1京都大学医生物学研究所細胞制御分野、2京都大学生命科学研究科高次細胞制御学分野、3大阪大学微生物病研究所分子免疫制御分野)
TAP-independent induction of N-myristoylated lipopeptide-specific CTLs in transgenic mice expressing the rhesus MHC class I allomorph, Mamu-B*098.
The Journal of Immunology (2025) doi: 10.1093/jimmun/vkaf082.
概要
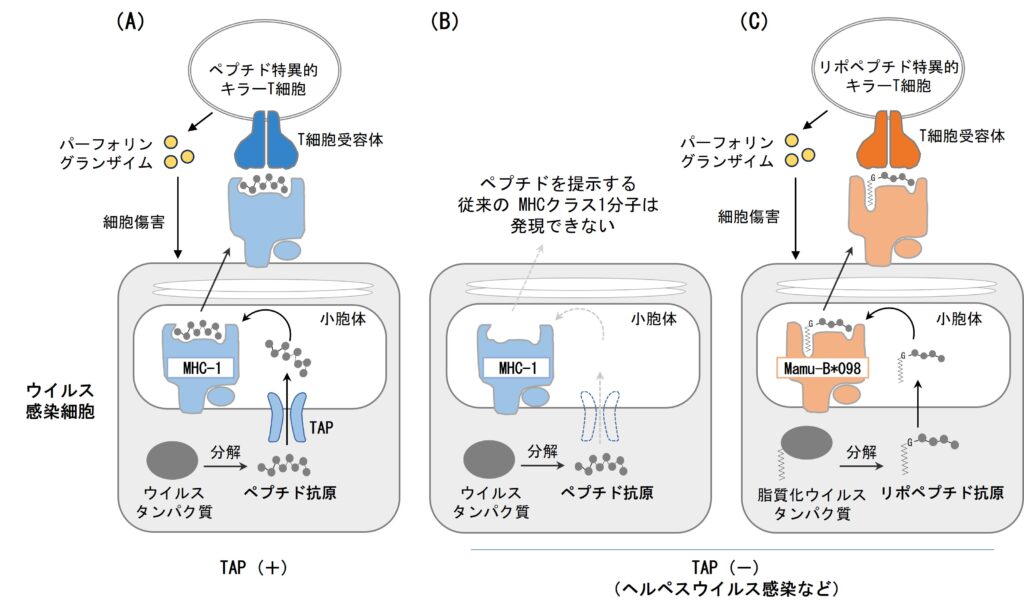
ウイルス感染細胞の細胞質において産生されたウイルスタンパク質はペプチドに断片化された後、小胞体膜に存在するペプチド輸送体(Transporter Associated with Antigen Processing; TAP)を介して小胞体内腔へと運ばれます。MHCクラス1分子(MHC-1)はこのペプチド抗原を結合した後、細胞表面へと発現し、特異的なキラーT細胞を活性化します(図A)。TAPはMHC-1の機能発現に必須の役割を果たしており、例えばTAPノックアウト(KO)マウスにおいて、MHC-1は細胞表面に発現できず、個体内のCD8陽性キラーT細胞数は著しく減少します(図B)。一方、近年の研究から脂質修飾を受けたウイルスタンパク質に由来する脂質化ペプチド断片「リポペプチド」を結合し、CD8陽性T細胞へと提示する新しいMHC-1サブセットの存在が明らかになりました(Nat Commun 2016)。従来のMHC-1とは対照的に、リポペプチド提示MHC-1分子はTAP欠損細胞株において正常に細胞表面に発現することができます(J Biol Chem 2020)。このことから、リポペプチド免疫応答はTAPを必要としない新しいキラーT細胞応答を担う可能性を想起し、その検証を行いました。
本研究ではアカゲザル由来のリポペプチド提示MHC-1であるMamu-B*098をコードする遺伝子を導入したトランスジェニック(Tg)マウスを作出し、TAP KOマウスと掛け合わせました。このモデルにおいて、Mamu-B*098は確かにTAP非依存的に細胞表面に発現し、末梢のCD8陽性T細胞数がnon-Tg/TAP KOマウスと比べて有意に回復しました。さらに、Mamu-B*098 Tg/TAP KOマウス由来のCD8陽性T細胞をリポペプチド抗原で刺激すると、リポペプチド特異的T細胞が高効率に誘導されることを見出しました。このリポペプチド特異的T細胞はパーフォリンやグランザイムなどのエフェクター分子を発現し、Mamu-B*098発現細胞をリポペプチド抗原存在下に傷害する典型的なキラーT細胞でした。
以上より、リポペプチド免疫はTAP非存在下でも機能し、特異的なキラーT細胞応答を誘導できることが示されました。TAPはウイルス感染やガンにおいてしばしば免疫逃避の標的となることが知られています。リポペプチド免疫応答はこうした病原体やガンに対抗する手段として特に有効であると考えらえます(図C)。